|
|
▲ KAIST 바이오및뇌공학과 조광현 교수(좌)
▲ 생명과학과 허원도 교수(우) |
심근비대증은 다양한 병인에 의해 심근세포가 비대해지는 병리학적 현상으로써 심부전증과 부정맥 등을 수반하는 주요 심장질환이다.
칼시뉴린-엔팻(calcineurin-NFAT) 신호전달경로는 이러한 심근비대증의 유발에 매우 중요한 역할을 하는 것으로 알려져 있다.
하지만 이 신호전달경로의 주요 조절단백질로 알려진 알캔(RCAN1)의 기능에 대해 많은 논쟁이 이어져 왔고 현재까지 그 구체적인 조절메커니즘이 밝혀지지 않았다.
KAIST 조광현 교수 융합연구팀은 이러한 복잡한 현상에 대해 수학 모델링과 대규모 컴퓨터시뮬레이션, 그리고 단일세포 분자 이미징 기술을 동원한 시스템생물학 융합연구를 통해 어크(ERK)와 지에스케이(GSK3)로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 새롭게 규명했다.
 |
|
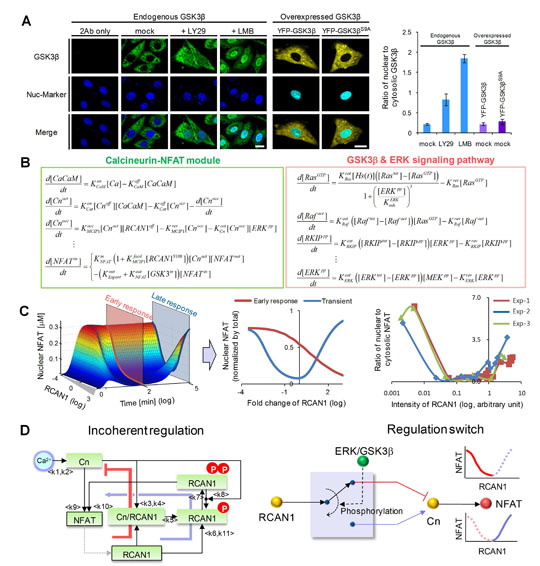
A. 단일세포 분자이미징 실험을 통해 피아이쓰리케이(PI3K)에 의해 지에스케이가 핵 밖으로 방출되고, 이로 인해 알캔의 조절역할은 신호의 억제자에서 촉진자로 전환됨. B. 칼시뉴린-엔팻 신호전달네트워크에 대한 미분방정식 모형. C. 대규모 컴퓨터시뮬레이션과 실험적 검증을 통해 알캔의 조절기능이 반응시간과 농도에 따라 변화됨을 규명. D. 어크와 지에스케이로 구성된 스위칭 회로가 칼시뉴린-엔팻 신호전달경로를 조절한다는 것을 규명. |
지금까지 많은 연구에서 알캔의 상반된 신호조절 역할이 보고돼 학계에서는 과연 무엇이 진실인가에 관한 논쟁이 이어졌다.
또한, 어떻게 동일한 분자가 그와 같이 서로 다른 기능을 보이는 것인지, 이를 유발하는 근본적인 메커니즘은 과연 무엇인지 등이 모두 수수께끼로 남아 있었다.
이번 연구를 통해 이러한 오랜 질문에 대한 해답이 제시됐으며, 알캔과 칼시뉴린-엔팻 신호전달경로의 근원적인 조절메커니즘이 시스템차원에서 최초로 규명됨으로써 앞으로 이를 표적으로 한 신약개발 및 관련 심장질환 응용연구의 중요한 발판을 마련하게됐다.
 |
|
▲ 저널오브셀사이언스 표지 |
이 연구는 교육과학기술부가 지원하는 한국연구재단의 기초연구실육성사업과 도약연구사업, 그리고 칼슘대사시스템생물학사업의 일환으로 수행됐으며, 연구 결과는 <저널오브셀사이언스(Journal of Cell Science)>의 표지논문으로 선정돼 오는 1월 1일자(온라인판은 2010년 12월 13일자)에 게재된다.
※ 칼시뉴린(calcineurin): 칼슘이온에 의해 활성화되는 단백질로서 엔팻을 탈인산화시키는 단백질.
※ 앤팻(NFAT): 전사인자로서 심근비대증의 발생에 중요한 역할을 하는 단백질.
※ 알캔(RCAN1): 칼시뉴린의 기능을 조절하는 단백질로서 병리학적 심근비대증의 발생에 중요한 역할을 한다.
※ 어크(ERK): 세포의 유사분열 신호를 전달하는 단백질.
※ 지에스케이(GSK3): 세포의 유사분열 및 생존과 관련된 신호를 전달하는 단백질.
※ 크로스토크: 두 신호전달경로 사이의 예측되지 않은 신호매개.
※ 단일세포 분자이미징기술: 단일세포내의 분자 발현을 현미경으로 관측 분석하는 기술.
Copyright © 의약일보