(Photo : )
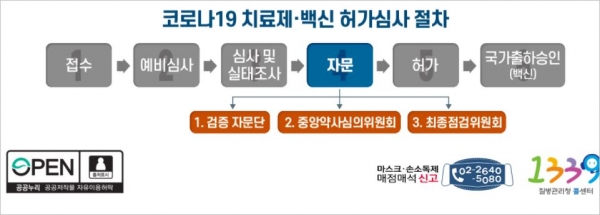
식약처, 코로나19 치료제 및 백신 허가심사 절차 ⓒ 식약처
식약처, 코로나19 치료제 및 백신 허가심사 절차 ⓒ 식약처
식품의약품안전처(식약청)이 코로나19 치료제·백신 허가심사의 객관성과 투명성 확보를 위해 외부 전문가 자문 체계를 보다 강화하겠다고 14일 밝혔다.
식약처에 따르면 현재 식약처는 약사법에 따라 새롭게 사용되는 의약품의 안전성·효과성에 관한 사항에 대해 '중앙약사심의위원회'를 운영하고 있다. 이 가운데 코로나19 이슈에 관하여서는 '코로나19 치료제/백신 안전성·효과성 검증 자문단'(이하 검증자문단)과 '최종점검위원회'를 추가 설치하도록 했다. 3중의 자문 절차가 수립되는 것이다.
자문은 검증 자문단, 중앙약사심의위원회, 최종점검위원회 순서로 진행된다.
'검증 자문단'은 중앙약사심의위원회 자문에 앞서 다양한 전문가들로부터 임상·비임상·품질 등 분야에 대한 자문 의견을 식약처가 수렴하는 절차로, 감염내과 중심의 임상 전문가, 비임상·품질·임상통계 등의 전문가 30명 내외로 전문가 인력풀로 구성됐다.
'중앙약사심의위원회'는 '약사법' 제18조에 따른 식약처 자문기구로서, 신청 품목의 안전성, 효과성, 허가 시 고려해야 할 사항 등을 자문하며, 생물의약품분과위원회의 상임위원과 관련 전문가 등 15명 내외로 구성되었다.
최종점검위원회는 10여 명의 내·외부 전문가가 공동으로 참여하여 식약처는 최종 허가 결정에 앞서 검증 자문단과 중앙약사심의위원회 자문결과를 토대로 최종점검을 실시한다.
Copyright © 의약일보










